Prototyp für die Zell- und Gentherapie Neue Produktionsplattform für die Gentherapie: Weniger Handarbeit, weniger Kosten
Noch sind die neuen Gen- und Zelltherapien teuer und bedeuten viel Handarbeit. Doch die Zulassungszahlen steigen und damit auch der Bedarf. Grund genug, für das auf Sterilabfüllung spezialisierte Unternehmen Optima Pharma, mit Partnern eine automatisierte Produktionsplattform zu entwickeln, die Zeit- und Kosten sparen soll. Wie Optima die Kosten für die Produktion senken will.
Anbieter zum Thema

Seit Novartis das CAR-T- Zell-Therapeutikum Kymriah entwickelt hat, werden in der Biopharmaproduktion die Karten neu gemischt. Die Liste der FDA an zugelassenen Zell- und Gentherapeutika umfasst derzeit über 20 Produktnamen und jedes dieser Advanced Therapy Medicinal Products ist ein echter Gamechanger.
ATMPs verändern weltweit Produktionsprozesse. Unternehmen arbeiten mit Hochdruck daran, das Hauptproblem der neuen Therapien zu beseitigen: viel Handarbeit, hoher Personaleinsatz und hohe Kosten. Seit 2019 hat sich auch Optima Pharma in diesen spannenden Markt eingeschaltet.
Gefördert vom Land Baden-Würtemberg entwickelt ein Optima-Team um Dr. Andrea Traube gemeinsam mit dem Robert- Bosch-Krankenhaus in Stuttgart und dem Universitätsklinikum Heidelberg die Technologieplattform „ProCell-for-Patient“.
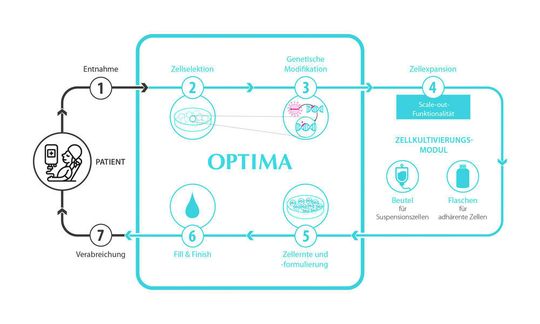
Das modular aufgebaute Konzept (siehe Grafik) besteht aus einem Isolator in dem die wesentlichen Schritte zur Herstellung von Zelltherapeutika automatisiert ablaufen und einem Zellkultivierungsmodul.
Traube kommt vom Fraunhofer IPA und entwickelt bei Optima Pharma als Director Market Development mit Schwerpunkt Systemlösungen für Zell- und Gentherapeutika seit 2018 neue Geschäftsfelder. Mit der Automatisierung von Zellkulturprozessen beschäftigt sie sich seit fast 15 Jahren und treibt nun das Procell-Projekt voran.
Mit Partnern erfolgreich
Man habe schnell erkannt, dass Optima trotz aller Expertise in der Roboter-, Automatisierungs-, Abfüll-, und Isolatortechnik solch ein Vorhaben nicht alleine stemmen kann, sagt sie. Nun ist also Prof. Dr. Walter E. Aulitzky, Chefarzt der Abteilung Onkologie, Hämatologie und Palliativmedizin am Robert- Bosch-Krankenhaus Stuttgart mit an Bord: ein anerkannter Experte für die Stammzellproduktion, der regulatorische Kenntnisse mitbringt und weiß, wie man später die CAR-T- Zell-Produktion ins Krankenhausumfeld integriert.
Prof. Dr. med. Michael Schmitt vervollständigt das Projekt-Konsortium und bringt das spezielle CAR-T-Zell-know-how mit. Schmitt hält die Siebeneicher-Stiftungsprofessor für Zelluläre Immuntherapie am Unversitätsklinikum Heidelberg und hat als einer der ersten in Deutschland die CAR-T- Zelltherapie gegen Leukämie eingesetzt. Er leitet die GMP-Facility in Heidelberg und hat eine Herstellerlaubnis nach §13 AMG für ein eigenes CAR-T-Produkt.
Der Prozess steht....
Auch das Team bei Optima Pharma kann sich sehen lassen: Automatisierungsspezialisten für die Robotertechnik, Entwicklungsingenieure für die Konstruktion, Informatiker, die die Software schreiben, Prozessingenieure, die an den Details des Dekontaminationszyklus tüfteln, ein Team von Metall+Plastic, das sich um den Isolatorbau kümmert.
Hinzu kommen Verantwortliche für Dokumentation, Qualifizierung und Risikoanalyse. Gute Voraussetzungen also für das Projekt, das jetzt in eine entscheidende Phase tritt. Die User Requirements, also die genaue Definition der für die Herstellung des Therapeutikums notwendigen Prozessschritte, stehen. Jetzt geht es ans Eingemachte.

„Für die URS haben wir den manuellen Prozess sehr detailliert aufgenommen. Die Kunst ist es, das in die Automatisierung zu übersetzen“, erklärt Traube. Für das Team bedeutet das vor allem: genau hinsehen, denn die Roboter, die später einen Teil der Automatisierung übernehmen sollen, sind im Vergleich zum Menschen Grobmotoriker. Selbst einfache Verrichtungen, wie etwa das Aufschrauben eines Gefäßes im Isolator, die der Pharmazeut ohne Nachzudenken aus dem Handgelenk schüttelt, muss für den Roboter in einzelne Schrittfolgen zerlegt werden.
In stundenlangen Workshops hielten die Teammitglieder alle Details auf Grafiken fest, auch um sicher zu sein, dass Biologen und Ingenieure die gleiche Sprache sprechen. Parallel dazu erfolgt gerade die Risikobetrachtung, um kritische Prozessschritte früh identifizieren zu können. Das sind z. B. die Schnittstellen rund um den Isolator. Eine der wichtigsten ist die zum Zellkulturgefäß, das außerhalb des Isolators steht.
Jetzt geht es in die Umsetzung
Ein Entscheidung die fiel, weil die Inkubation, in der sich die gentechnisch modifizierten T-Zellen vermehren, die meiste Zeit des rund zweiwöchigen Prozesses den Isolator blockieren würde. „Wir erarbeiten gerade eine spezifische Schnittstelle zu einem Standard-Inkubator, wie er auch in einer GMP-Facility eingesetzt wird, um den Transfer in und aus dem Isolator zu gewährleisten“, sagt Traube, hüllt sich aber aus Gründen des IP-Schutzes über Weiteres in Schweigen.
Doch gerade solche Schnittstellen seien wichtig für die spätere Vermarktung. „Unser Anspruch ist Flexibilität und Modularität. Wir entwickeln eine Plattformlösung, die später weitere neue Therapieformen abdecken soll. Deshalb wollen wir in der Lage sein, möglichst viel sowohl auf dem Markt erhältliche als auch neue Technologie zu integrieren“, betont Traube. Im Visier: außer der neuen Zielgruppe Klinik-Herstellung, Big Pharma und CDMOs. Geplant sei auch, die Technologie in verschiedenen Ausbaustufen anzubieten, z. B. mit einem manuellen Produktionsisolator, das sei dann auch für Biotechfirmen interessant.
Herstellung könnte um die Hälfte billiger werden
Noch kosten alle Zelltherapien viel Geld: Über 300.000 Euro steht z. B. für die Novartis-Therapie Kymriah im Raum. Ein Teil davon entfällt auf die Herstellkosten, die durch Plattformtechnologien wie die von Optima Pharma sinken sollen. „Allein durch Personaleinsparung durch die Automatisierung und die geringere Reinraumklasse in der der Isolator stehen kann, glauben wir, dass wir 50 Prozent der Kosten einsparen können“, sagt Traube. Auch die momentan meist noch proprietären Single-Use-Komponenten sind teuer, weshalb man bei Procell auf Standardkomponenten setzt.
Ende des Jahres wird es noch einmal spannend. Bis dahin soll die Konstruktion fertig sein. Im Sommer 2022 geht`s in die Pilotversuche. Und dann heißt es: Daumen drücken, dass die Behörden die Herstell-Genehmigung nach § 13 AMG schnell erteilen. ●
(ID:47751200)





:quality(80)/p7i.vogel.de/wcms/df/ea/dfea806db5c38156a17fab42b6b81afb/0129733277v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/45/47/4547317dd9195a829f5f7e5f79ef9cb6/0129721551v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/d4/a9/d4a94b39ace2b1e09dccbcaaba7e4b02/adobestock-531620266--20metamorworks-20-20stock-adobe-com-2143x1205v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/ed/01/ed017da1d17e336975a4d16f18e52175/0129307971v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/5b/7c/5b7c36de7a8ce0c912d94c3720430caa/0129005682v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/b2/25/b2252e0d74827c474938a19f667a1841/0127827374v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/cf/b0/cfb0e7efb9b6e5672ff50b43a07d179e/0128888473v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/cf/09/cf0975f2fcf6be2d8c3a4ed786674e7f/0129560848v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/23/f3/23f361183c09d9d63c2c5bd81a829c73/0129516512v4.jpeg)
:quality(80)/p7i.vogel.de/wcms/b2/2c/b22c7a7efbb4ed86f9394377b45526c7/0129358083v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/a0/17/a01720c3e123e049081d0dbbd75f3fcc/0129243154v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/94/a0/94a01dc20cdade2729c13db4555bfe23/0129554680v4.jpeg)
:quality(80)/p7i.vogel.de/wcms/2d/28/2d28a36e1120a63c1fa290fa3d098cda/0129442387v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/b2/af/b2af357d3000af6cfd0b0d45ec5f3bf4/0128614557v3.jpeg)
:quality(80)/p7i.vogel.de/wcms/0e/72/0e72bb75b43afd74f3afd88c77c51e46/schraubtec-la-2025-c2-a9tinografiert-076-5000x2811v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/35/9f/359fa1366b51fcf9f743d28f2babc477/0129527462v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/82/1f/821fc3e325fe033a4184b4053d3d3d42/0129557944v3.jpeg)
:quality(80)/p7i.vogel.de/wcms/84/a5/84a52dc6473444dd510906a8dde147e1/0129600251v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/59/f4/59f460c45fa0765c523553bec32b3e00/0129646125v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/96/d6/96d64baffae6c4844d06ebae90bcbc18/0129491147v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/cd/ea/cdea0a9dff9db08b6fa004efd7af9a8f/0129524487v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/4c/d6/4cd6446e617bccb1c4898b3e055e73e6/0129620835v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/29/d7/29d702619e030f2a6cf82904b7d74cc8/0129498336v3.jpeg)
:quality(80)/p7i.vogel.de/wcms/78/08/78082e2c5c40c2cf391113c8a9c42f97/0128109021v3.jpeg)
:quality(80)/p7i.vogel.de/wcms/66/e1/66e19d7e4bf91b1e5a639daa038c3cd6/0129082515v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/1d/10/1d10f518fa7bcf7c07fef62b4de409fb/0127811686v4.jpeg)
:quality(80)/p7i.vogel.de/wcms/b0/cc/b0cc98ce9eb8868be3859cb513d2b594/0129211756v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/88/4b/884b2004cb12e4782e6412c7bf783c95/0129074527v4.jpeg)
:quality(80)/p7i.vogel.de/wcms/76/c7/76c7017de262c977b968a997da7c6188/0129739933v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/7a/ee/7aee67c456c0dd5e2fe32d8d9f433d4f/0129586768v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/a5/9e/a59e9628e2c8ea914f63f82989dc062d/0129242430v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/8a/a1/8aa1cd7e3e60e8b6608f134cc51b2c8d/0128367970v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/ad/0c/ad0c5cda40a2d6c970f60acfae6be603/0128270121v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/fe/c0/fec0f87a15e8a446035ab3a45e9a49ba/0128235678v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/71/b4/71b43f5588655bf89cbc3faeb311ea78/0126955685v3.jpeg)
:quality(80)/p7i.vogel.de/wcms/9a/d9/9ad99104c6f6685d534af0dbef9c0ace/0126730715v1.jpeg)
:quality(80)/p7i.vogel.de/wcms/de/fa/default_article/default-article-image.jpeg)
:quality(80)/p7i.vogel.de/wcms/f7/5a/f75aaf9fec8bfd3c7b97b6023578db8f/0126258414v2.jpeg)
:fill(fff,0)/p7i.vogel.de/companies/62/98/62987c083933c/ness-w--rmetechnik-gmbh.jpeg)
:fill(fff,0)/images.vogel.de/vogelonline/companyimg/34900/34909/65.jpg)
:fill(fff,0)/p7i.vogel.de/companies/68/c8/68c815bc8fe81/prominent-logo-300x300.jpeg)
:quality(80)/p7i.vogel.de/wcms/40/bf/40bf6784ff20ff8106c29b4144ae6ee4/0127378919v2.jpeg)
:quality(80)/p7i.vogel.de/wcms/4f/c6/4fc61151f697c139a8349491619c05da/0127802555v1.jpeg)